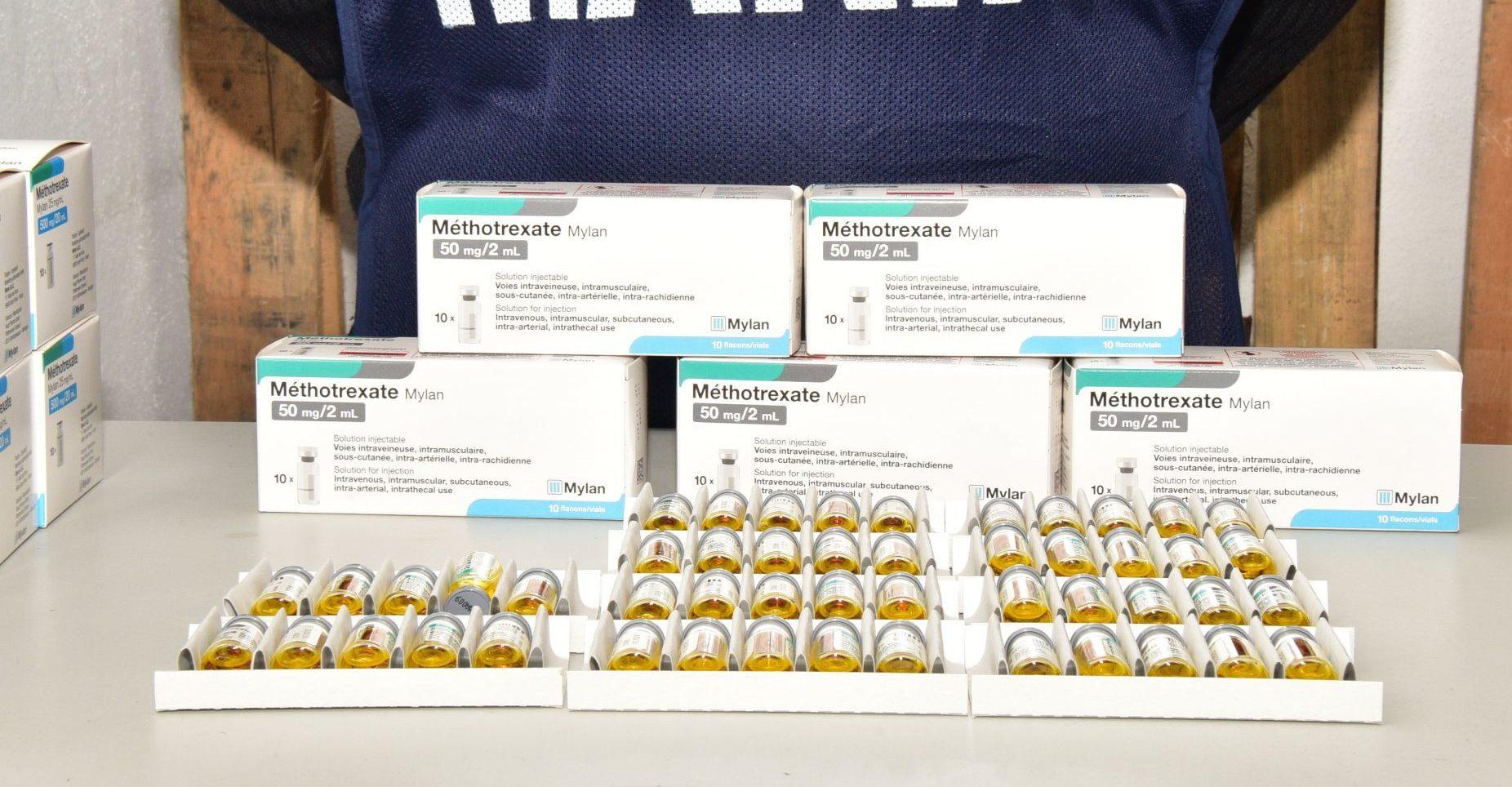
Al menos un medicamento para tratamiento de cáncer comprado el año pasado por el Gobierno federal para combatir el desabasto se administró a pacientes sin contar con el registro sanitario de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris).
El metotrexato, que llegó en septiembre de Francia, no tenía el permiso normativo para ser administrado en México y a pesar de eso fue distribuido por las autoridades del sector salud, según testimonios recolectados por Mexicanos contra la Corrupción y la Impunidad con médicos de hospitales públicos e institutos de salud. Esas fuentes hablaron bajo condición de permanecer en el anonimato.
Hasta el día de ayer, en la página de Cofepris no aparece el registro sanitario del productor Laboratorios Mylan para el metotrexato. Tampoco el del medicamento oncológico vincristina, que recientemente se compró a Pfizer y que llegó de Estados Unidos para ser administrado a niños con cáncer.
Lee más: Muere Alexis, niño con cáncer; desabasto de medicinas afectó su salud, dice su mamá
El subsecretario de Salud, Hugo López Gatell, confirmó que el metotrexato se adquirió sin registro sanitario de Cofepris. Sin embargo, el funcionario alegó que el medicamento tiene las aprobaciones de EMA, la Agencia Europea de Medicamentos, y que la importación fue posible gracias a un convenio internacional firmado por México.
“México hará uso de un convenio internacional con países de más altas estándares de regulación reconocidos por la Organización Mundial de la Salud”, dijo López Gatell.
Según el subsecretario a cargo del abasto de medicamentos, tal convenio no se había utilizado porque las empresas farmacéuticas mexicanas tenían coptado el mercado y la regulación.
López Gatell negó que las miles de dosis del medicamento para el cáncer que llegaron en septiembre fueran de dudosa calidad, porque tienen registros de otros países.
El subsecretario encargado del abasto de medicamentos aseguró que aunque no tengan registro sanitario de México, cuando llegan los medicamentos importados Cofepris realiza una inspección sanitaria.
“Cualquier producto que va a ser de uso humano está sujeto a una inspección y hay unos protocolos técnicos donde Cofepris tiene que reconocer los lotes y hay varias modalidades, existe la liberación simplificada, la liberación con revisión exhaustiva lote por lote”, dijo López Gatell.
Cofepris nunca respondió a múltiples peticiones de MCCI para que mostraran los registros sanitarios de ambos medicamentos o la inspección sanitaria. Tampoco Laboratorios Mylan dio respuesta a varias solicitudes de entrevista para verificar el registro de Cofepris del medicamento que vendieron.
Lee: CNDH pide a autoridades de salud atender a mujeres con cáncer que no puedan pagar a Fucam
Aunque el metotrexato tiene la aprobación de la Federal Drug Administration, FDA, el equivalente estadunidense a Cofepris, y de la agencia europea EMA, según expertos eso sólo indica que el compuesto químico es efectivo para tratar un padecimiento, pero no que se hayan seguido todos los procedimientos correctos de elaboración y transportación.
La desregulación para registros sanitarios empezó en marzo de 2019, cuando la Secretaría de Salud emitió el primer decreto para que quien pida el registro de un medicamento en México pudiera presentar la precalificación de la Organización Mundial de la Salud para agilizar el trámite.
El 28 de enero del 2020 se publicó en el Diario Oficial de la Federación un acuerdo más de la Secretaría de Salud para importar medicamentos aunque no cuenten con los permisos sanitarios de Cofepris. El acuerdo otorga cinco días hábiles después de la importación de medicamentos para iniciar el proceso para obtener el registro sanitario. La nueva regla provocó reacciones de la industria farmacéutica porque eso implica que nadie verifique la calidad y seguridad de los fármacos.
Un grupo de padres de niños con cáncer ha solicitado a la Secretaría de Salud que les permitan hacer pruebas de laboratorio de los medicamentos. El gobierno federal ha respondido que los medicamentos son de calidad y que tienen certificaciones incluso mejores que las mexicanas.
“Vienen con certificaciones óptimas, mejores que las de México, dicen ‘queremos ver la calidad’, pueden verla, pero son mejores que las de México, son de Suiza, Francia, Estados Unidos”, les dijo a los padres la secretaria de Gobernación, Olga Sánchez Cordero en una reunión llevada a cabo el 4 de febrero.
En septiembre, después del desabasto de medicamento para tratar el cáncer, el gobierno federal anunció la compra de 38 mil 200 unidades de metrotexato a Laboratorios Mylan. Con esto, se acabaría el desabasto y se combatiría el monopolio del medicamentos que según el gobierno federal tenía la farmacéutica mexicana Pisa.
Lee: Juez ordena al gobierno surtir de medicamentos a 65 niños con cáncer
El lote fue enviado por los mismos laboratorios desde Francia. El 21 de septiembre, el vocero de presidencia, Jesús Ramírez Cuevas, publicó en Twitter fotografías de la llegada del medicamento. El subsecretario de Salud, Hugo López Gatell, la entonces oficial mayor de la Secretaría de Hacienda, Raquel Buenrostro, y el almirante de la Secretaría de Marina Mario Carbajal aparecen en la foto con el camión en el que llegaron las cajas con el medicamento.
Los medicamentos fueron distribuidos en los institutos de salud y hospitales de tercer nivel.
En el Instituto de Cancerología, dijeron médicos consultados, el medicamento estuvo al menos una semana en almacén porque los permisos no estaban en orden. Cuando fue liberado los médicos supusieron que ya había licencias para utilizarlo, pero nunca vieron el registro.
En otros hospitales de especialidades los directivos decidieron administrar el medicamento desde su llegada valorando que tenía aprobación de FDA y que después de días o semanas de desabasto, los pacientes lo requerían urgentemente.
“Del metotrexato nunca llegó el registro sanitario”, dijo el directivo de un hospital.
Un médico dijo a MCCI que el metotrexato no es el único medicamento que ha sido distribuido sin registro sanitario, y que le han llegado medicinas incluso por mensajería, sin que esté verificada, por ejemplo, la cadena de frío que muchas medicinas requieren.
Miguel Ángel Ávila, director de la unidad de radiofarmacia de la facultad de Medicina de la UNAM, explicó que si un medicamento no tiene registro sanitario de Cofepris no se está vigilando que cumpla con todos los controles que requiere un fármaco.
Sin ser experto en medicamentos de cáncer, Ávila explicó que tener un registro sanitario extranjero como el de FDA no garantiza que se haya cumplido con todos los procesos y controles que requiere un medicamento.
“No es solamente la producción y los controles de calidad y la certificación, también tiene que ver con la cadena de suministro. Hay fármacos que requieren condiciones especiales para ser transportados. Cuando traen fármacos de otros países ¿cómo puede garantizarse esa cadena de suministro, condiciones especiales que normalmente se refiere a temperatura como la cadena de frío?”, dijo el doctor en física médica.
Otros expertos dijeron a MCCI que la inspección sanitaria no es un proceso que esté regulado o contemplado en la ley.
A principios de enero volvieron las quejas por desabasto de medicamentos. En esa ocasión, los padres de niños con cáncer del hospital infantil Federico Tello, denunciaron la falta del medicamento vincristina .
El 23 de enero el presidente Andrés Manuel López Obrador anunció que había autorizado 60 millones de pesos para la compra del medicamento.
Los hospitales recibieron vincristina de la farmacéutica Pfizer y los padres de los niños con cáncer fueron informados que sería administrado inmediatamente.
La compra se hizo por adjudicación directa ante la emergencia y en la página de Cofepris no aparece ningún registro del genérico vincristina a nombre de Laboratorios Pfizer.
A pesar de las compras de emergencia, los reportes de desabasto de medicamentos con cáncer continúan. Un grupo de padres acudió a las vías judiciales y obtuvo un amparo para que el gobierno federal garantice el medicamento oncológico para sus hijos.
